本記事の内容は、女心を読み取るのが下手な私のただの妄想です。医療関係者ではないため、誤解している内容が含まれている可能性がありますので、本記事を信用しないでください。また、本記事の内容を何かしらの判断材料にしないでください。
「GERD(胃食道逆流症)」の治療薬として、従来の「PPI(プロトンポンプ阻害剤)」とは異なるメカニズムで、PPIよりも速やかにかつ持続的に胃酸分泌を抑制する「P-CAB(カリウムイオン競合型アシッドブロッカー)」と呼ばれる新しい作用機序の胃酸分泌関連疾患治療剤があります。
2019年2月現在、日本で販売されているP-CABは、武田薬品工業の「タケキャブ(ボノプラザン)」のみとなっています。
タケキャブは、PPIより酸分泌抑制効果が高いという理由などで、2019年2月現在、処方されることが多く、売上高も非常に好調です。
GERDは、食道粘膜障害を有する「ERD(びらん性胃食道逆流症)」と食道粘膜障害の認められない「NERD(非びらん性胃食道逆流症)」を含みます。
日本医事新報社のWebサイトでは、NERDについて以下のように説明されています。
非びらん性胃食道逆流症(non-erosive reflux disease:NERD)とは,胃内容物が食道に逆流することによる胸焼けや呑酸などの症状があるにもかかわらず,内視鏡所見で食道に粘膜傷害を認めないものである。
日本人のGERDの「60%」は、このNERDと言われています(参考資料)。
つまり、日本で販売する薬において、NERDの適応症を承認取得できた場合は、NERDの患者が多い分、その薬の売上も伸びると考えられます。
従来のPPIでは、NERDの適応症を承認取得しているものがありますが、P-CABのタケキャブは2019年2月現在、まだ日本でNERDの適応症で承認取得していません。
そのため、タケキャブはNERDの適応症の承認取得をするために、日本でNERDを適応症とした治験(臨床試験)のフェーズ3を行っていました。
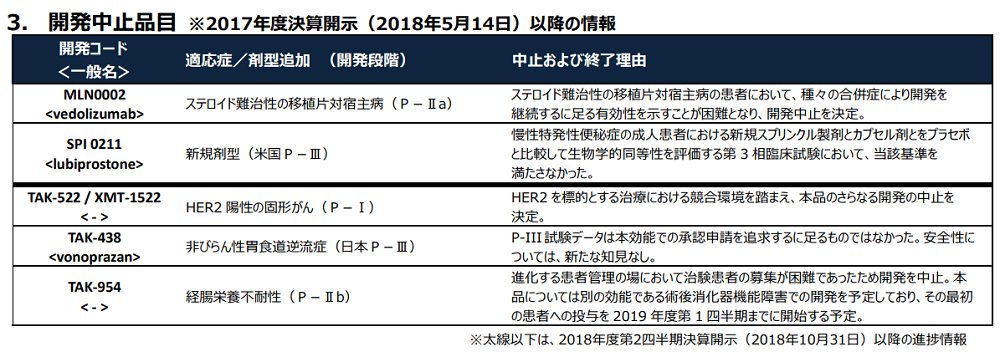
しかし、2019年2月1日に武田薬品から決算発表があり、武田薬品のパイプライン情報が記載されているデータブックも更新されましたが、そこにタケキャブのNERDの適応症について開発中止と記載されていました(2018年度第3四半期 DATA BOOK)。
開発コード「TAK-438」がタケキャブのことです。
記載されている開発中止の理由は以下です。
P-III試験データは本効能での承認申請を追求するに足るものではなかった。安全性については、新たな知見なし。
つまり、タケキャブはNERDの症状に対して、承認申請をしても承認取得をできるような統計的有意差がなかったと考えられます。
また、タケキャブは、以前にも日本でNERDを適応症とした治験のフェーズ3を行っており、そのときも承認取得ができるような結果を得られていません。
そのときの治験の報告書が以下です。
[TAK-438 治験総括報告書(2013年10月31日)]
2回も治験を行い、2回目もNERD適応症の承認申請に至る結果が得られませんでした。
大企業の武田薬品のことですから、治験の再挑戦をするときは、相当念入りに試験の計画を立てたと考えられます。
治験をするには、莫大な費用が掛かるため、再挑戦での失敗は許されないレベルでしょう(とは言っても、仕方ありませんが)。
しかし、今回の結果になってしまいました。
武田薬品が3度目のNERD適応症の治験を今後行うのかは不明ですが、もしも行わず、かつ、今後も日本でP-CAB製品としてタケキャブしか発売されることがなかった場合は、日本でNERDを適応症としたP-CABが今後も存在しないことになります。
そして、タケキャブが日本でNERDの適応症を承認取得しない限り、日本では、NERDの症状に対しては、保険を適用(適応)してタケキャブを処方することができません。
しかし、面白いことに、ネット上の患者さんの書き込みを見ていると、内視鏡所見で食道に粘膜傷害を認められなくても、保険適用でなぜかタケキャブが処方されている患者がいるようです。
どうやら、NERDの症状だったとしても、NERDの症状としてではなく、それより範囲が広い、GERDの症状などとして、タケキャブが処方されているようなことが一部であるっぽいです。
おそらく、今後もタケキャブ以外のP-CABが日本で発売されない限り、NERD適応症で承認取得していないタケキャブがNERDの症状の患者さんに、保険適用で処方され続けることになるでしょう。
もしそうなると、日本で問題になっている社会保障費の増加にも不必要に繋がるでしょう。
そもそも、何のための治験、何のための承認制度なのだろうと医療関係者ではない私からすると思ってしまいます。
日本の医療制度の仕組みは謎です。
一方、日本では2019年2月2日現在、タケキャブ以外に開発が進行中のP-CABはありませんが、韓国では、「tegoprazan(テゴプラザン)」というP-CABが開発されており、2019年に韓国で発売される予定です。
さらに、このtegoprazanは、なんとNERDの適応症もP-CABとして世界初で韓国において承認取得しています。
つまり、世界で見れば、2019年2月2日現在、P-CABとしては、tegoprazanが世界で唯一NERDの適応症を取得しています。
しかも、このtegopraznは、「ラクオリア創薬」という日本企業の薬(化合物)です。
それならば、韓国ではNERDの適応症を取得できた日本企業のtegoprazanを日本で開発すれば良いのでは?と医療関係者ではない人は思うでしょうが、なぜか日本では2019年2月2日現在、tegoprazanが開発進行していません。
ちなみに、ラクオリアは創薬企業であり、現在のビジネスモデルが、開発初期段階の化合物を他社の製薬企業に導出するというモデルであるため、ラクオリアは自社でtegoprazanを開発する予定は現在ないです。
そもそも、ベンチャー企業であり、収益もまだ少ないため、tegoprazanの開発を自社で進める資金がありません。
そのため、ラクオリアは日本の製薬企業にtegoprazanを導出する活動をしているのですが、契約してくれる日本の製薬企業が2019年2月2日現在いない状態です。
一方、tegoprazanは、韓国だけではなく、現在、中国でも開発中であり、ベトナムでも今後発売される予定です。
なぜ、日本企業の世界初の薬が他国では発売されるのに、日本では発売予定がないのか、不思議です。
日本で現在発売済みの薬だけでは、症状が改善されなかったり、薬の服用タイミングなどが不便だったり、副作用が出るGERD患者のためにも、今後より良い薬が日本で販売されることを願っています。



コメント